14.3: Activación de macrófagos y células NK
- Page ID
- 55398
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivos de aprendizaje
- Describir cómo las células efectoras T H 1 son capaces de interactuar y activar macrófagos.
- Describir cómo las células NK son capaces de reconocer y destruir las células infectadas y las células cancerosas que carecen de moléculas MHC-I.
Después de interactuar con APC, algunos linfocitos T4 ingenuos se diferencian en un subconjunto de células efectoras llamadas células T H1. Las células T H 1 funcionan principalmente para promover la fagocitosis de microbios y la destrucción de microbios intracelulares.
Activación de Macrófagos
Los linfocitos efectores T4 llamados células T H 1 coordinan la inmunidad contra las bacterias intracelulares y promueven la opsonización por los macrófagos. Producen citocinas como el interferón gamma (IFN-? ) que promueven la inmunidad mediada por células contra patógenos intracelulares, especialmente activando macrófagos que han ingerido patógenos o se han infectado con microbios intracelulares como Mycobacterium tuberculosis, Mycobacterium leprae, Leishmania donovani, y Pneumocystis jiroveci que son capaces de crecer en las vesículas endocíticas de macrófagos. La activación del macrófago por las células T H 1 mejora en gran medida su efectividad antimicrobiana (Figura\(\PageIndex{1}\)).
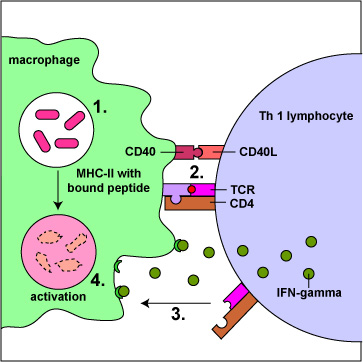
Producen citocinas que promueven la producción de aumentos en la producción de IgG opsonizante y activadora del complemento que potencia la fagocitosis (Figura\(\PageIndex{1}\)).

- Producen receptores que se unen y matan a las células infectadas crónicamente, liberando las bacterias que estaban creciendo dentro de la célula para que puedan ser engulladas y matadas por los macrófagos.
- Producen citocinas como el factor de necrosis tumoral alfa (TNF-a) que promueven la diapedesis de los macrófagos.
- Producen la quimiocina CXCL2 para atraer macrófagos al sitio de infección.
Los linfocitos T asesinos naturales activados (células NKT) también producen grandes cantidades de IFN-gamma para activar macrófagos.
Activación de macrófagos Aumenta su producción de radicales tóxicos de oxígeno, óxido nítrico y enzimas lisosómicas hidrolíticas permitiendo la destrucción de microbios dentro de sus fagolisosomas. También hace que los macrófagos secreten citocinas como TNF-a, IL-1 e IL-12. TNF-a e IL-1 promueven la inflamación para reclutar leucocitos fagocíticos. LL-12 permite que los linfocitos T4 ingenuos se diferencien en células T H 1. Además, la activación aumenta la producción de moléculas coestimuladoras B7 y moléculas MHC-1 por macrófagos para aumentar la activación de linfocitos T.
Activación de células NK
Las citocinas como la interleucina-2 (IL-2) y el interferón gamma (IFN-gamma) producidas por los linfocitos T H1 activan las células NK. Las células NK son otro grupo de linfocitos citolíticos, distintos de los linfocitos B y linfocitos T, que participan tanto en la inmunidad innata como en la inmunidad adaptativa. Las células NK son linfocitos que carecen de receptores de células B y receptores de células T. Están diseñados para matar ciertas células mutantes y células infectadas por virus de una de dos maneras:
1. Las células NK destruyen las células a las que se han unido moléculas de anticuerpos a través de un proceso llamado citotoxicidad celular dependiente de anticuerpos (ADCC) como se muestra en la Figura\(\PageIndex{3}\)\(\PageIndex{4}\), Figura y Figura\(\PageIndex{5}\). “La porción Fab del anticuerpo se une a epítopos en la célula “" extraña "”.” A continuación, la célula NK se une a la porción Fc del anticuerpo. La célula NK es entonces capaz de entrar en contacto con la célula e induciendo un suicidio celular programado llamado apoptosis.
2. Células NK para usar un sistema receptor de duelo para determinar si matar o no a las células humanas. Cuando las células están bajo estrés, se están convirtiendo en tumores, o se infectan, se producen diversas moléculas como MICA y MICB y se ponen en la superficie de esa célula. El primer receptor, llamado receptor activador de asesinos, puede unirse a diversas moléculas como MICA y MICB que se producen y se ponen en la superficie de esa célula, y esto envía una señal positiva que permite a la célula NK matar a la célula a la que se ha unido a menos que la segunda el receptor cancela esa señal. Este segundo receptor, llamado el receptor asesino-ihibitorio, reconoce moléculas MHC-I que también suelen estar presentes en todas las células humanas nucleadas. Si las moléculas de MHC-I se expresan en la célula, el receptor inhibidor de asesinos envía una señal negativa que anula la señal de muerte y evita que la célula NK destruya esa célula (Figura\(\PageIndex{6}\)).

Los virus y la transformación maligna a veces pueden interferir con la capacidad de la célula infectada o la célula tumoral para expresar moléculas de MHC-I. Sin la señal del receptor inhibidor de asesinos, la señal de muerte de la señal activadora de asesinos no se anula y la célula NK mata la célula a la que se ha unido (Figura\(\PageIndex{7}\)).

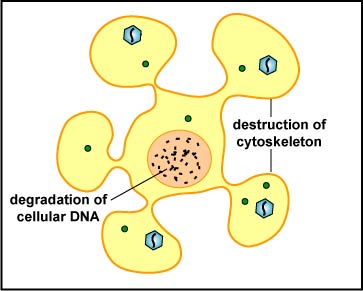
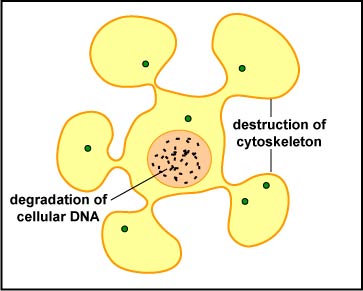
La célula NK libera proteínas formadoras de poros llamadas perforinas y enzimas proteolíticas llamadas granzimas. Las granzimas pasan por los poros y activan las enzimas que conducen a la apoptosis de la célula infectada por medio de la destrucción de sus proteínas citoesqueléticas estructurales y por degradación cromosómica. Como resultado, la célula se rompe en fragmentos que posteriormente son eliminados por macro fagos (Figura\(\PageIndex{5}\)). Las rforinas de PE también pueden dar lugar a lisis celular. La distinción entre causar apoptosis versus causar lisis celular es importante porque lisar una célula infectada por virus solo liberaría los viriones, mientras que la apoptosis conduce a la destrucción del virus en su interior.
Las células NK también producen una variedad de citocinas, incluyendo citocinas proinflamatorias, quimiocinas, factores estimulantes de colonias y otras citocinas que funcionan como reguladores de las defensas corporales. Por ejemplo, a través de la producción de citocinas, las células NK también suprimen y/o activan los macrófagos, suprimen y/o activan las capacidades de presentación de antígeno de las células dendríticas y suprimen y/o activan las respuestas de
Al igual que con la inmunidad humoral, ciertos microbios son capaces de evadir hasta cierto punto las células NK:
- El citomegalovirus (CMV) también puede desencadenar que su célula hospedadora produzca moléculas MHC-I alteradas que son incapaces de unirse a epítopos virales y, por lo tanto, no son reconocidas por los CTL. Sin embargo, las células NK tampoco son capaces de matar a esta célula infectada porque todavía está mostrando “moléculas MHC-I” en su superficie.
- El CMV también produce microARN (miARN), pequeñas moléculas de ARN no codificantes que regulan a la baja la producción de proteínas inducidas por estrés que el receptor activador de asesinos de las células NK reconoce primero. Los miARN hacen esto uniéndose al ARNm de la célula huésped que codifica proteínas inducidas por estrés (Figura\(\PageIndex{14}\).3.9). Sin esta unión no hay señal de muerte por parte de la célula NK.
- El citomegalovirus (CMV) y el virus del herpes simple tipo 1 (HSV-1) producen microARN (miARN), pequeñas moléculas de ARN no codificantes que bloquean la proteína involucrada en la apoptosis, un suicidio celular programado. Los miARN hacen esto uniéndose al ARNm de la célula huésped que codifica proteínas inductoras de apoptosis (Figura\(\PageIndex{9}\)).

Figura\(\PageIndex{9}\): ARN antisentido (microARN o miARN). Cuando un ARN antisentido (microARN o miARN) que es complementario a un ARNm que codifica una proteína o enzima en particular se une al ARNm mediante emparejamiento de bases complementarias, ese ARNm no se puede traducir y la proteína o enzima no se elabora.
Resumen
- Los linfocitos efectores T4 llamados células T H 1 coordinan la inmunidad contra las bacterias intracelulares y promueven la opsonización por los macrófagos.
- Las citocinas producidas por las células T H 1 promueven la inmunidad mediada por células contra patógenos intracelulares activando macrófagos y potenciando su efectividad antimicrobiana, aumentando la producción de IgG opsonizante y activadora del complemento que potencia la fagocitosis, y promoviendo la diapedesis y quimiotaxis de macrófagos al sitio de infección.
- La activación de linfocitos T asesinos naturales (células NKT) produce grandes cantidades de IFN-gamma para activar macrófagos.
- Las citocinas como la interleucina-2 (IL-2) y el interferón gamma (IFN-gamma) producidas por los linfocitos T H1 activan las células NK.
- Las células NK activadas destruyen las células a las que se han unido moléculas de anticuerpos a través de un proceso llamado citotoxicidad celular dependiente de anticuerpos (ADCC).
- Las células NK activadas también utilizan un sistema receptor de duelo para determinar si matar o no a células como las células cancerosas y las células infectadas que están mostrando moléculas de estrés y no están produciendo moléculas de MHC-I.
- Las células NK matan las células infectadas y las células cancerosas induciendo apoptosis, un suicidio celular programado.


